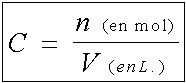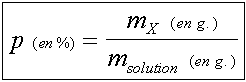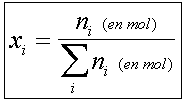| Les Solutions Aqueuses |
Solutions,
Concentrations, Dilutions |
 |
|
 |
|
 |
DIFFERENTES
EXPRESSIONS DE LA CONCENTRATION
Soit un composé X
présent dans une solution, on peut définir la composition de la solution en X
en utilisant différentes relations :
- la concentration molaire est le rapport de la quantité
de matière de X (en mol) contenue dans un certain volume de solution
divisée par ce volume de solution exprimé en L. C’est donc également
la quantité de matière de X contenue dans un litre de la solution.
La concentration molaire a donc pour unité la mol.L-1.
La concentration molaire est souvent également appelée molarité
; elle est alors symbolisée par la lettre M. Ainsi une solution
de sulfate de sodium 0,2 M contient 0,2 mol de sulfate de formule Na2SO4
dans un litre ; on dit qu’il s’agit d’une solution à 0,2 mol.L-1
ou encore 0,2 fois molaire.
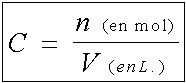
-
On utilise souvent les « crochets » pour noter
une concentration molaire : ainsi [Cl2]
= 0,0012 mol.L-1 signifie qu’un litre de
solution contient 0,0012 mol de dichlore dissous. La distinction entre C et
[ ] est assez subtile : C représente la concentration "de
fabrication" et [ ] la concentration réelle ; ces concentrations
seront différentes quand on fabrique une solution de concentration C d'un
composé X qui peut se transformer partiellement en Y une fois dissout dans
l'eau : on a alors la relation :
C = [X] + [Y]
par exemple, dans le
cas de la solution à 0,2 mol.L-1 d'acide éthanoïque CH3COOH, ce
composé se dissociant partiellement en ions éthanoate CH3COO-
, suivant la réaction :
CH3COOH
+ H2O <=> CH3COO-
+ H3O+ ,
on aura
C = 0,2 mol.L-1
= [CH3COO] + [CH3COO-].
- la concentration massique: C’est le rapport de
la masse de composé X contenu dans un certain volume de solution divisée par
ce volume de solution. La masse est exprimée en kg ou en g et le volume souvent
exprimé en L et parfois en m3. Le terme
concentration désigne souvent soit la concentration molaire soit la concentration
massique sans que cela soit précisé; il convient de bien noter l’unité correspondante
qui seule permet de différencier les deux types de concentration.

- le pourcentage en masse ou fraction massique : C’est le rapport de la masse
de composé X contenu dans un certain volume de solution divisée par la masse
de ce volume de solution. Ce rapport est obligatoirement compris entre
0 et 1. On a pris l'habitude de l'exprimer en % pour manipuler des nombres
compris entre 0 et 100 : par exemple une solution de X à 10% contient 10g
de composé X pour 100g de solution. Le pourcentage en masse ne présente d’intérêt
que lorsque l’on utilise des solutions très concentrées.
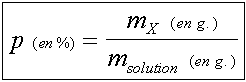
- la fraction molaire : C’est le rapport de la quantité
de matière de X (en mol) contenue dans un certain volume de solution divisée
par la somme des quantités de matière de tous les constituants présents dans
ce volume de solution . Une fraction molaire est un nombre sans dimension.
Si on note ni la quantité de matière du composé i et xi sa fraction molaire,
cette dernière se calculera à partir de la relation ci-contre.
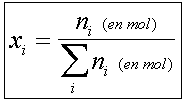
La fraction molaire est peu utilisée pour exprimer les concentrations
des solutés dans des solutions diluées ; en revanche, elle sert pour exprimer
la composition des mélanges.
- la molalité: elle correspond
à la quantité de matière de X pour 1 kg de solvant. Cette unité de concentration
n’est que très rarement utilisée.
- la normalité : cette unité de concentration qui
a été largement utilisée présente l’inconvénient de dépendre de la réaction
par laquelle on va utiliser cette solution... Ainsi, on définit la normalité
d’une solution acide dans l’eau comme le nombre de mol d’ion H3O+ susceptible
d’être libérés par un litre de solution. De même, la normalité oxydo-réductrice
d’une solution correspond au nombre de mol d’électrons susceptibles d’être
libérés par un litre de solution : dans ce dernier cas, la normalité dépend
de la nature de espèce chimique avec laquelle on peut faire réagir la solution...
En dépit de son caractère parfois « pratique », nous n’utiliserons pas la
normalité dans la suite de ce module.
| Les Solutions Aqueuses |
Solutions,
Concentrations, Dilutions |
 |
|
 |
|
 |