|
INFLUENCE DE LA TEMPERATURE SUR LA COMPOSITION DE L'EAU PURE
Dans l’eau pure, les concentrations des ions H3O+ et OH- sont identiques et égales à (Ke)1/2. Le calcul des concentrations des ions H3O+ et OH- dans l’eau à une température différente de 25°C exige donc que l’on connaisse la variation de Ke avec la température.
Comme toute constante d’équilibre, la variation de Ke avec la température T (exprimée en K) suit la loi de Van t’Hoff :
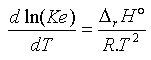
où DrH° est l’enthalpie standard de la réaction d’auto-protolyse, qui vaut 56,3 kJ.mol-1 à 298 K (25°C). Cette enthalpie de réaction étant positive, la constante Ke va augmenter avec la température. Puisque l’on connaît Ke à 298K, il suffit d’intégrer l’équation différentielle ci-dessus entre T = 298 K et une température T quelconque pour laquelle l’eau sera encore liquide pour calculer Ke à la température T :
si l’on suppose que DrH° ne varie pas sensiblement avec T dans l’intervalle [ 298, T ] on obtient la relation :
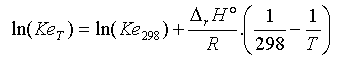
A T = 323 K par exemple, on trouve Ke = 5,54 10-14
et donc des concentrations
Ces concentrations ont donc plus que doublé quand la température de l’eau est passée de 25°C où [H3O+ ] = [OH-] = 1,00 10-7 mol.L-1 à 50°C où [H3O+] = [OH‑] = 2,35 10-7 mol.L-1.
La variation de la concentration de l’espèce H2O est beaucoup plus faible puisqu’elle ne dépend que de la variation de la masse volumique de l’eau avec la température. On trouve dans les tables de données concernant l’eau que , à 50°C, la masse volumique de l’eau vaut 0,9881 kg.L-1. La masse molaire de l’eau étant toujours égale à 18,02 g.mol-1, la concentration [H2O] à 50°C est égale à :
![]() ,
,
valeur à peine plus faible qu’à 25°C (55,34 mol.L-1).