|
AUTRES DOSAGES
Dosage par complexation
Une réaction formant un complexe peut être utilisée comme réaction de dosage, pourvu qu’elle remplisse les conditions que doit remplir une telle réaction, à savoir être totale et instantanée. Le signal indiquant la fin de la réaction correspond souvent à la formation d’un autre complexe d’une couleur différente de celle du complexe formé au cours du dosage. Il faut bien entendu que ce second complexe n’apparaisse que lorsque le taux d’avancement de la réaction de dosage est aussi proche que possible de 100%. C’est ce qui se passe , par exemple ,au cours du dosage des ions chlorure Ca++ par l’ion E.D.T.A. Y4- en présence de l’indicateur « noir d’ériochrome T » symbolisé par la formule HNet2- bleu en absence d’ion calcium et rouge en présence d’ion calcium :
Dosage complexométrique des ions calcium par l’E.D.T.A. :
La solution à doser contient des ions calcium. Cela peut être une par exemple l’eau « du robinet » dont la teneur en calcium varie considérablement d’une région à l’autre.
|
La solution titrante est une solution d’ions d’E.D.T.A. (anion éthylènediaminetétraacétate tétravalent et symbolisé par Y4- ), c’est à dire une solution de sel de sodium d’E.D.T.A., Na 4Y totalement dissocié en 4 Na+ et Y4- . |
|
L’ion Y4- possède des propriétés basiques : c’est une tétrabase dont les pKa sont les suivants :
|
Couple |
Y4- / HY3- |
HY3- /H2Y2- |
H2Y2- / H3Y- |
H3Y - / H4Y |
|
pKa |
10,3 |
6,2 |
2,7 |
2,0 |
Pour que l’E.D.T.A soit présent sous la forme Y4- , il faut donc
que le milieu soit basique ; pour que le changement de couleur lié à la
présence de l’indicateur coloré soit net,le dosage s’effectue en milieu tamponné
à pH # 10. A ce pH, l’espèce majoritaire est HY3- mais
la réaction du dosage consommant tous les ions Y4- , l’équilibre
![]() sera
considérablement déplacé vers la gauche.
sera
considérablement déplacé vers la gauche.
La réaction du dosage est :
![]()
Le complexe formé est incolore.
( On peut également écrire la réaction en faisant intervenir l’espèce majoritairement présente à pH = 10, l’ion HY3- :
![]() à pH = 10
à pH = 10
|
L’indicateur de fin de dosage est le noir d’ériochrome T ; on introduit initialement dans l’eau à doser quelques gouttes d’une solution assez concentrée de noir d’ériochrome T ; tant qu’il reste des ions Ca2+, le complexe CaNet-,rouge peut se former, et la couleur de la solution à doser est donc rouge. |
Noir d’ériochrome
T
|
Dès que la totalité des ions Ca2+ a réagi avec Y4-, il ne reste plus assez d’ions calcium pour que CaNet- soit présent et la solution a la couleur du noir d’ériochrome seul, c’est à dire celle de l’ion HNet2- bleue. La réaction de formation de ce complexe avec le noir d’ériochrome T est :
![]()
La décoloration du milieu du implique que le complexe CaY 2- soit plus stable que le complexe CaNet – à pH = 10.
Le noir d’ériochrome T existe lui aussi sous plusieurs formes acidobasiques diversement colorées : HNet 2- est bleu alors que H2Net – est rouge et queH3Net est orange.
Les pKa correspondant aux différents couples sont rassemblés dans le tableau suivant :
|
Couple |
Net 3- / HNet 2- |
HNet 2- /H2Net - |
H2Net - / H3Net |
|
pKa |
11,6 |
6,3 |
1,2 |
On constate que pour bien voir la transition de couleur du rouge au bleu à l’équivalence du dosage, il faudra être en milieu basique entre pH 8 et 10. Un milieu trop basique correspondrait au passage du rouge à l’orange peu visible à l’oeil et un milieu acide à une transition du rouge au rouge donc imperceptible !
Evolution des espèces au cours du dosage :
Dans un erlenmeyer, plaçons 100 mL d’eau « du robinet » et 20 mL d’une solution tampon concentrée à pH = 10 ; ajoutons quelques gouttes d’une solution de noir d’ériochrome T : la solution prend une coloration rouge due à la présence du complexe CaNet- . Tout au long du dosage, le pH du milieu restera quasiment constant et égal à 10.
Dans la burette au dessus de l’erlenmeyer, introduisons une solution de sel disodique d’E.D.T.A. à 0,01 mol.L-1 ; l’E.D.T.A. présent dans la burette se trouve essentiellement sous la forme d’ions H2Y 2- mais dès qu’elle sera introduite dans l’erlenmeyer à pH = 10 ; les ions H2Y2- se transformeront en ions HY3- et Y4-. Versons des quantités croissantes de cette solution et agitons pour homogénéiser rapidement le milieu : au voisinage de l’équivalence, la coloration rouge disparaît pour être remplacée par une coloration bleue ; ce changement de couleur correspond à la transformation globale :
![]()
Cette réaction est quasiment totale car le complexe CaNet- est beaucoup moins stable que le complexe CaY2-.
L’évolution des quantités de matière est présentée sur le graphique suivant :
Les quantités des espèces issues de l’indicateur NET ( colorées en rouge, bleu et orange) sont reportées sur l’axe de droite du graphique.
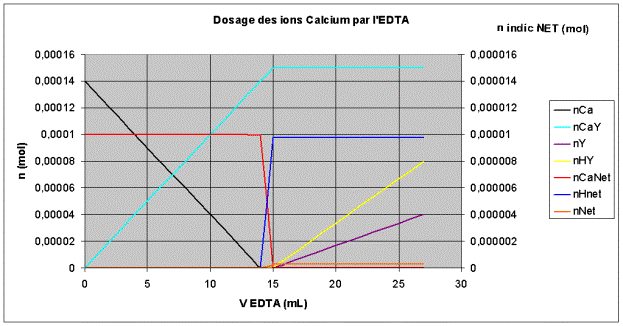
On constate que le volume équivalent Ve (en mL) permet de retrouver la concentration d’ions calcium dans l’eau :
![]()
On a donc : CCa = 0,01 . Ve / 100 mol.L-1.
Degré hydrotimétrique :
La méthode de dosage complexométrique exposée ci-dessus s’applique indifféremment aux ions calcium et magnésium Mg2+.
La teneur d’une eau en ions calcium et magnésium que l’on appelle « dureté de l’eau » est généralement exprimée en « degré hydrotimétrique °H » :
Le degré hydrotimétrique correspond au volume équivalent Ve mesuré lors du dosage de 100mL d’eau par une solution d’E.D.T.A. à 0,01 mol.L-1.Une eau potable ne doit pas dépasser 50°H ; une eau « douce » de bonne qualité a un degré hydrotimétrique de moins de 15°H.