|
|
Nous avons vu au paragraphe précédent
que l'enthalpie libre d'un système dans lequel la transformation X à P se produit a pour expression
:
G = ( 1-x ).( µ°X
+ R.T ln (aX) ) + x . ( µ°P + R.T ln (aP)
)
Nous allons à présent étudier la variation de G en fonction de x suivant l'état physique de X et P et en tirer les conséquences quand à l'évolution du système .
Pour un gaz parfait, l'activité est définie comme le rapport de sa pression partielle à la pression de référence p° = 1 bar.
Nous avons donc aX = pX /p° = gX . pt / p° où gX est la fraction molaire de X dans le mélange gazeux et pt la pression totale des gaz dans le mélange. Cette pression étant constante et égale à p° = 1 bar, il vient :
aX = gX = nX / (nX + nP) = (1 - x ) / 1 et de même aP = x / 1
L'expression de G devient donc G = (1 - x).(µ°X + R.T ln (1 - x) ) + x . ( µ°P + R.T ln (x) )
soit G - µ°X = x . DrG° + (1 - x). R.T ln (1 - x) + x . R.T ln (x)
ou encore si T = 298K : G - µ°X = DrG°. x + 2493 . ((1 - x). ln (1 - x) + g . ln (x) )
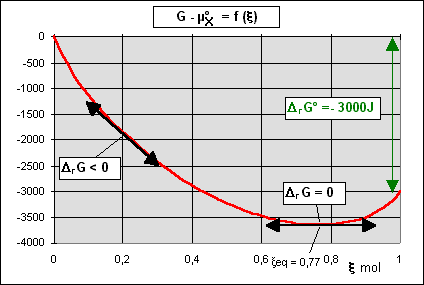 |
Dans le cas où DrG°vaut - 3000 J.mol-1,
la courbe ci-contre (en rouge) représente
les variations de G - µ°X en fonction de l'avancement
x de
la réaction X (gaz) à P (gaz) . La pente
de la tangente à cette courbe représente DrG puisque par définition
DrG = dG/dx .
Lorsque x = 0, DrG est négatif donc la réaction X (gaz) à P (gaz) va se produire et x va croître. Cette réaction va se poursuivre jusqu'à ce que G soit minimum, c'est à dire jusqu'à ce que x = xeq et DrG = 0. |
xeq = 0,77 mol correspond donc à l'avancement de la réaction à l'équilibre, la composition du système étant alors de 0,77 mol de P et 0,23 mol de X.
Notez bien sur ce graphique la différence qu'il y a entre G du système, DrG et DrG°.
L'animation ci-dessous vous permet de faire varier l'enthalpie libre standard DrG° de la réaction et de visualiser l'influence de cette variation sur la forme de la courbe G = f(x) . Elle vous permet également de constater l'influence de cette variation sur la position d'équilibre.
Lorsqu'une transformation du type X à P se déroule dans un système à température constante, la transformation s'arrète lorsque l'avancement de réaction est tel que l'enthalpie libre du système atteint la valeur la plus faible possible.
Lorsque la transformation X à P se produit en phase homogène, cette valeur de G correspond à un minimum, c'est à dire à la valeur de x = xeq telle que dG/dx = DrG = 0 .
La valeur de xeq dépend de DrG° : plus DrG° est négative et plus la valeur de xeq est proche de la valeur maximale qui correspond à un taux d'avancement de réaction de 100% . Au contraire, plus DrG° est positive et plus xeq est faible et proche de zéro.
SIMULATEUR
Vous trouverez la simulation suivante dans la section simuler. Pour y accéder,
cliquez sur l'icône ![]() dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
simulations sont toujours interactives.
dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
simulations sont toujours interactives.
|
Simulateur de l'évolution de l'enthalpie libre d'un système en cours d'évolution. Ce simulateur vous permet de visualiser la variation de G en fonction de l'avancement de réaction pour des réactions de type a A à b B, lorsque A et B sont dans divers états physiques. Il vous permet également de faire varier le DrG° associé à la transformation et de constater l'influence de ce paramètre sur la position d'équilibre. Vous pourrez aussi étudier l'influence de la pression totale sur la position d'équilibre, comparer plusieurs situations en visualisant plusieurs courbes simultanément, comparer l'évolution à pression ou à volume constant.... |