|
Aprés avoir vu comment on calcule K à une température T , nous allons montrer comment on mesure expérimentalement une constante d'équilibre .
Etudions un système dans lequel la transformation aA + bB à g C + dD peut se produire et attendons suffisemment longtemps pour que l' état d'équilibre de ce système soit atteint (en fait , attendons assez longtemps pour que nous ne percevions plus d'évolution macroscopique dans l'évolution du système )
L'égalité entre K et le quotient réactionnel à l'équilibre Qeq , permet de calculer la constante K à partir des mesures des variables d'état du système. Il faut toutefois qu'à partir de ces valeurs nous soyons en mesure d'expliciter les activités aA, aB, etc...de A, B, C et D , c'est à dire que nous puissions calculer les pressions partielles (gaz) ou les concentrations (solutions) ou les fractions molaires (mélanges liquides) des différents composés impliqués dans la transformation.
La relation K = Qeq est connue sous le nom curieux de loi d'action de(s) masse(s).
Elle s'écrit : 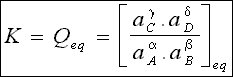
PROBLEME D'AUTO-APPRENTISSAGE .
Vous trouverez le problème suivant dans la section s'exercer.
Pour y accéder, cliquez sur l'icône ![]() dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
exercices sont conçus pour vous apprendre à les résoudre : leur originalité
est de proposer une aide guidée très détaillée et progressive.
dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
exercices sont conçus pour vous apprendre à les résoudre : leur originalité
est de proposer une aide guidée très détaillée et progressive.
Calcul de la constante d'équilibre associée à une réaction chimique à partir de l'état final d'un système.Une réaction chimique est tirée au sort et les états initiaux et finaux du système vous sont fournis : vous devez alors calculer les activités de chacun des constituants du système pour obtenir le quotient réactionnel à l'équilibre donc la valeur de la constante d'équilibre. |