| Etude de la cinétique de la réaction d'hydrolyse de l'acétate d'éthyle par dosage. |
Etude de la cinétique de la réaction d'hydrolyse de l'acétate d'éthyle par dosage.
| Vous pouvez aller directement voir | la simulation de la manipulation |
L'addition d'une solution de soude à une solution d'acétate d'éthyle CH3COOC2H5 entraîne la réaction d'hydrolyse :
CH3COOC2H5
+ OH- ![]() CH3COO-
+ C2H5OH
CH3COO-
+ C2H5OH
On opère à la température ambiante (un thermomètre permet de la mesurer), et on s'intéresse aux premiers instants de la réaction. Dans ces conditions, les concentrations en ions acétate et en éthanol restent suffisamment faibles pour que la réaction inverse puisse être négligée.
|
Vortex due à l'agitation. |
A l'instant t = 0, Pour faire cette agitation, on utilise |
|
|
A intervalles de temps réguliers,
Cette prise d'essai est rapidement vidée
Le temps est relevé lorsque la pipette
est à demi-vidée. |
Les erlenmeyers numérotés destinés à recevoir les prises d'essai contiennent initialement 100 mL d'une solution de HCl 0,01 M (soit 10-3 mol d'ions H3O+) et 2 gouttes de phénolphtaléine, incolore dans ces conditions.
Le mélange réactionnel est formé par mélange de
100 mL d'une solution d'acétate d'éthyle 0,1 M et de 100 mL d'une solution de
soude 0,1 M.
10 mL de ce mélange contiennent 5.10-4 mol d'ions OH-,
à t = 0. Cette quantité diminue dans le temps en raison de la consommation
de cette espèce par la réaction de saponification.
Des dosages par retour, permettent de déterminer la quantité de soude consommée.
 Avant virage |
 Après virage |
Dosage de l'excès d'acide.
Le point équivalent de ce doasge correspond au virage de la phenolphtalëine.
Les volumes VNaOH
de solution de soude 0,1 M nécessaires aux dosages des excès
d'acide présents dans les erlenmeyers sont reportés dans le tableau
: La concentration Ct de soude dans le mélange réactionnel
au temps t s'obtient en égalant les quantités d'acide et
de base présentes au point équivalent du dosage.
Par exemple, pour t = 2 min, on obtient :
nH+ = nOH-
10-3 = 10-2 C2 + 6,70.10-3.10-1
C2 = 0,033 mol L-1.
En répétant cette démarche pour les temps 4, 6, 8, 10 et
12 min, on complète le tableau
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Simulation de la manipulation :
Traitement des données expérimentales :
Pour déterminer les ordres partiels de la réaction par rapport à l'ester et par rapport à l'ion hydroxyde, on teste les modèles issus de l'étude formelle. Par exemple, pour une réaction d'ordre 0, on sait que la concentration de l'espèce réactif décroît linéairement dans le temps selon :
Pour une réaction d'ordre partiel 1 par
rapport à la base OH- et d'ordre partiel 0 par rapport à
l'ester, 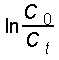 est
une fonction linéairement croissante de t.
est
une fonction linéairement croissante de t.
Pour une réaction d'ordre partiel 1 par
rapport à la base OH- et d'ordre partiel 1 par rapport l'ester, ![]() est
une fonction linéairement croissante de t.
est
une fonction linéairement croissante de t.
Les valeurs nécessaires pour tester ces modèles ont été reportées dans le tableau :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
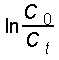
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
et les points correspondants sont montrées sur les figures suivantes :
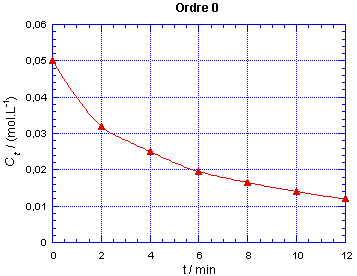
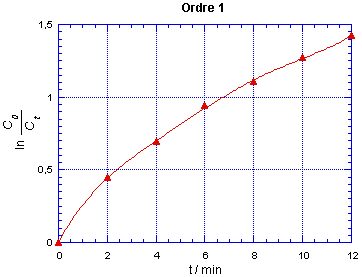
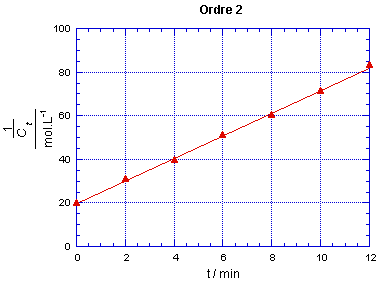
On observe que les points ne sont alignés
que pour le cas correspondant à l'ordre 2. On peut alors tracer la droite
qui passe par ces points, elle a pour ordonnée à l'origine
1/C0 = 20,0 mol-1.L pour t = 0. La réaction
est bien d'ordre partiel 1 pour chacun des réactifs, donc d'ordre 2.
Le
coefficient directeur de cette droite conduit au coefficient de vitesse de la
réaction : k = 5,20 mol-1.L.min-1.
| Etude de la cinétique de la réaction d'hydrolyse de l'acétate d'éthyle par dosage. | Fin |