|
INFLUENCE DE LA TEMPERATURE SUR LA SOLUBILITE
La solubilité d’un composé dépend de la valeur du produit de solubilité Ks du composé et la valeur de Ks dépend de la température T selon la loi de Van t’Hoff :
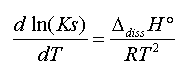
oùDdissH°représente l’enthalpie standard de dissolution du composé ionique que l’on considère généralement indépendante de la température (on prend le plus souvent sa valeur à 298K) .
C’est le signe de l’enthalpie standard de dissolution qui détermine le sens del’évolution de la solubilité s avec la température T . Dans une grande majorité des cas, la dissolution d’un composé ionique est endothermique, l’enthalpie de dissolution est donc positive et le produit de solubilité Ks augmente quand la température s’élève . La solubilité étant toujours une fonction croissante de Ks on comprend que le plus souvent la solubilité d’un composé ionique augmente avec la température.
L’enthalpie standard de dissolution est parfois appelée chaleur de dissolution ; on calcule sa valeur à partir des tables d’enthalpies standard.
Exemple de l’influence de la température sur la solubilité de l’iodure de plomb :