|
FORMATIONS DE PRECIPITE PAR MELANGE DE DEUX SOLUTIONS.
On appelle précipitation la formation d’un composé solide quand on mélange deux solutions limpides. Vous pouvez voir ci-dessous un exemple de la précipitation de l’hydroxyde Fe(OH)3 quand on mélange une solution de chlorure de fer (III) et une solution d’hydroxyde de sodium :
| Précipitation de l'hydroxyde de fer (III) |
Une réaction de précipitation est exactement l’inverse d’une réaction de dissolution ; ses caractéristiques thermodynamiques (enthalpie, enthalpie libre, etc…) sont donc de signe opposé à celles de la réaction de dissolution mais de même valeur absolue.
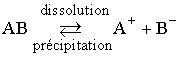
Calcul des conditions de précipitation :
Quels volumes de deux solutions connues doit on mélanger pour qu’un précipité se forme c’est à dire pour que l’on observe un début de précipitation ?
Soit un becher contenant 10 mL d’une solution à c1 = 0,01 mol.L -1 de chlorure de sodium Na+ Cl -; on verse dans ce récipient un volume v (mL) d’une solution à c2 = 0,01 mol.L-1 de nitrate d’argent (Ag+ NO3 - ). Quel volume minimum v doit-on verser pour qu’il y ait précipitation de chlorure d’argent AgCl ?
La réaction qui peut se produire est :![]()
dont la constante K = 1 / Ks est très grande.
Quand le précipité se formera, la relation suivante sera vérifiée :
![]()
Nous allons donc exprimer les concentrations des ions en fonction de v et chercher la valeur de v telle que cette relation soit vérifiée :
Initialement, la concentration des ions chlorure est de c1 = 0,01 mol.L-1 ; quand on ajoute v mL de solution de nitrate d’argent et qu’il n’y a pas encore précipitation,la concentrations des ions chlorure devient :
![]()
La concentration des ions argent vaut alors, dans les mêmes conditions :
![]()
et l’équation indiquant le début de précipitation :
![]()
Faisons l’approximation selon laquelle le volume v à verser est très petit par rapport à 10 mL, l’équation donnant v se simplifie beaucoup :