|
PRECIPITATION SELECTIVE.
Que se passe t’il quand on introduit une solution dans un mélange et que deux précipités différents du même cation peuvent se former ? Observe t’on une précipitation simultanée ou successive et dans ce cas, quel précipité se forme le premier ?
Le précipité qui se forme le premier est celui pour lequel la condition de précipitation Qi = Ksi est vérifiée la première (Qi est le quotient réactionnel correspondant à la réaction de dissolution du composé i et Ksi le produit de solubilité associé).
Lorsque les deux précipités ont une formule chimique du même type (par exemple AgCl et AgBr), c’est le précipité associé à la plus faible valeur de Ks qui apparaît le premier.
Si l’écart entre Ks1 et Ks2 est assez grand (par exemple si les deux produits de solubilité diffèrent d’un facteur supérieur à 100), le second précipité n’apparaît que lorsque la réaction de précipitation du premier est quasiment totale.
Exemple : on verse une solution du composé ionique nitrate d’argent AgNO3 dans une solution contenant un mélange d’ions chlorure, bromure et sodium. Qu’observe-t’on ?
On peut envisager la précipitation de deux composés :
AgClKs1 = 1,8 10 –10 et AgBr Ks2 = 5 10 –13. (voir les tables de Ks)
Suivant les réactions :
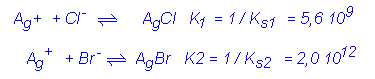
On constate que K1 et K2 sonttrès
élevées mais que la réaction 2 est prépondérante puisque K2 est supérieure
à K1. On observera donc la formation d’un précipité de bromure
d’argent AgBr ; ce n’est que lorsque tous les ions bromure auront quasiment
disparu de la solution que le précipité de chlorure d’argent AgCl pourra se
former . (cette dernière constatation s’explique par la valeur élevée du rapport
Pour une approche quantitative de ce problème voir l’exercice dans la section « s’exercer ».