|
QU'EST-CE QU'UN COMPLEXE
On appelle “complexe” le composé formé par l’association d’un cation métallique avec des molécules ou des ions susceptibles de fournir un doublet électronique au cation ; ces donneurs de doublet sont appelés ligands .
Les cations formant des complexes sont souvent des métaux de transition, c’est à dire des éléments possédantdes électrons décrits par des orbitales de type « d »,par exemple Cu, Ag, Fe, Cr, Pt, etc.…, ou des éléments situés juste après les éléments de transition dans la classification périodique des éléments comme Al, Sn, Pb, etc…
Les ligands :
Les ligands sont de différents types ; parmi les plus courants on trouve des molécules comme l’eau H2O ou l’ammoniac NH3 ou des anions comme les chlorures Cl- , les cyanures CN- , les hydroxydes OH- et bien d’autres.
Certains ligands peuvent fournir plusieurs doublets électroniques : il s’agit alors de molécules assez volumineuses qui possèdent bien sûr plusieurs doublets électroniques non liants : il faut que ces doublets soient suffisamment éloignés les uns des autres pour que la molécule donneuse de doublets puisse s’entourer autour du cation métallique un peu comme une pieuvre étendant ses tentacules… un ligand de ce type est appelé polydentate .
On parle de bidentate pour deux doublets, tétradentate pour quatre, hexadentate pour six.
Parmi les polydentates les plus courants citons :
|
L’éthylène diamine, bidentate (les atomes d’azote porteurs d’un doublet sont représentés en rouge) |
|
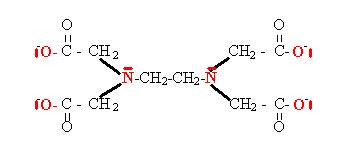
L’éthylène diamine tétra-acétique (EDTA) qui est un ion portant quatre charges négatives , hexadentate : (les six doublets intervenant dans une liaison avec le cation ont été représentés en rouge sur le schéma ci-dessous ; ils proviennent de 4 atomes d’oxygène et de 2 atomes d’azote également représentés en rouge). Cet ion est symbolisé fréquemment par le symbole Y4-.
Structure géométrique des complexes :
Elle dépend du nombre de doublets qui vont entourer l’ion métallique. Ce dernier se trouve au centre d’une figure géométrique dépendant de ce nombre. Ainsi le complexe sera linéaire s’il comprend deux ligands, il sera triangulaire pour trois doublets, tétraédrique ou carré pour quatre, octaédrique pour six.
|
La figure ci-contre représente la structure d’un ion complexe du cuivre II avec le ligand NH3. Sa formule chimique est Cu (NH3)4 2+ et sa structure est carrée . Les atomes donneurs de doublets sont représentés en rouge et les traits fins verts matérialisent la structure géométrique du complexe (carré) ; ce ne sont pas des liaisons. |
|
|
Un exemple plus complexe correspond à une complexation par l’EDTA : la figure ci-contre représente la structure d’un ion complexe du calcium avec l’hexadentate Y4-. Sa formule chimique est Ca Y 2+ et sa structure est octaédrique . Les atomes donneurs de doublets sont représentés en rouge et les traits fins verts matérialisent la structure géométrique du complexe (octaèdre) ; ce ne sont pas des liaisons. |
|
Réactions de complexation :
D’une façon générale, la formation d’un complexe à partir d’un cation C c+ et de n ligand Ly- s’écrira :
![]()
Bien entendu, à cette réaction est associée une constante d’équilibre K.
On écrira par exemple :
![]()