|
DOSAGES CONDUCTIMETRIQUES
Conductivité d'une solution. Conductivités molaires.
Le courant électrique dans la solution provient du déplacement des ions sous
l’influence du champ électrique appliqué ; plus ce déplacement est rapide
et plus le courant sera important. La conductivité ![]() de
la solution va donc dépendre à la fois de la concentration Ci
des ions i présents dans la solution, de leur charge électrique zi
et de leur nature ou plus précisément de leur vitesse de déplacement
dans un champ électrique (leur mobilité ui ), les ions les
plus petits étant les plus « mobiles ». La conductivité de la solution
est donc la somme de termes relatifs à chacun des ions présents dans la solution ;
les cations et les anions vont se déplacer en sens opposé sous l’influence d’un
champ électrique, mais leurs charges électriques étant elles aussi opposées,
leurs contributions au courant total s’additionnent à condition de ne pas attribuer
de signe à leurs charges. La relation donnant
de
la solution va donc dépendre à la fois de la concentration Ci
des ions i présents dans la solution, de leur charge électrique zi
et de leur nature ou plus précisément de leur vitesse de déplacement
dans un champ électrique (leur mobilité ui ), les ions les
plus petits étant les plus « mobiles ». La conductivité de la solution
est donc la somme de termes relatifs à chacun des ions présents dans la solution ;
les cations et les anions vont se déplacer en sens opposé sous l’influence d’un
champ électrique, mais leurs charges électriques étant elles aussi opposées,
leurs contributions au courant total s’additionnent à condition de ne pas attribuer
de signe à leurs charges. La relation donnant ![]() est donc :
est donc :
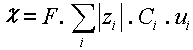
où F est le Faraday soit 96 500 C , Ci la
concentration de l’ion i en mol.m-3 et ![]() la
valeur absolue de la charge de l’ion i. Cette relation se simplifie quelque
peu en introduisant la notion de conductivité molaire ionique
la
valeur absolue de la charge de l’ion i. Cette relation se simplifie quelque
peu en introduisant la notion de conductivité molaire ionique ![]()
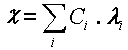
La conductivité molaire d’un ion dépend donc de sa charge et de sa taille mais aussi de la température et de l’environnement de cet ion, c’est à dire de la présence d’autres particules chargées au voisinage de cet ion. li dépend donc de Ci mais cette dépendance est toutefois assez limitée et en première approximation, on peut écrire :
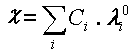
où l°i est la conductivité molaire limite de l’ion i, c’est à dire la conductivité molaire de l’ion i extrapolée à concentration Ci nulle.
|