|
DOSAGES CONDUCTIMETRIQUES
Tables de conductivité molaires limites.
Les conductivités molaires s’expriment en S.mol-1.m2. Leurs valeurs se trouvent dans des tables qu’il faut examiner avec la plus grande attention : en effet, lorsque l’ion est polyvalent, il est fréquent de trouver plusieurs valeurs différentes pour le même ion : cela résulte de ce que dans certaines tables on indique la conductivité molaire pour une « mole de charge » ; la notation est alors différente : par exemple pour l’ion Al3+, on trouvera suivant les tables :
![]()
C’est la première valeur qu’il convient d’utiliser dans la formule de la
page précédente ; on remarque bien sûr que
D’autres tables donnent la conductivité molaire d’un composé ionique « complet », c’est à dire comprenant anion(s) et cation(s) . Il s’agit alors de la somme des conductivités molaires ioniques :
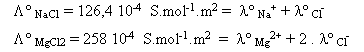
ATTENTION : Pour effectuer des calculs avec ces valeurs de conductivités molaires, il faut exprimer les concentrations en mol.m-3et non comme nous y sommes habitués en mol.L-1.
Tableau de conductivités molaires ioniques (10-4 S.mol-1.m2) à 25°C
|
Cation |
104 . l° |
Anion |
104 . l° |
|
H+ |
350,0 |
OH- |
198,4 |
|
K+ |
73,54 |
Cl- |
76,39 |
|
Na+ |
50,12 |
Br- |
78,18 |
|
Li+ |
38,7 |
I- |
76,88 |
|
Ba2+ |
127,2 |
NO3- |
71,50 |
|
Ca2+ |
119,1 |
HCO3- |
44,5 |
|
Pb2+ |
139,0 |
CH3COO- |
40,9 |
|
Cu2+ |
107,2 |
C6H5COO- |
32,4 |
|
Mg2+ |
106,2 |
SO42- |
160,0 |
|
Ag+ |
61,9 |
PO43- |
278,4 |
|
NH4+ |
73,4 |
F- |
55,4 |
|
Al3+ |
189,0 |
HPO42- |
114,0 |
Tableau de conductivités molaires de composés ioniques (10-4 S.mol-1.m2) à 25°C
|
HCl |
LiCl |
NaCl |
KCl |
NH4Cl |
NaI |
KI |
NaCH3CO2 |
NaOH |
|
426,2 |
115,0 |
126,5 |
149,9 |
149,7 |
126,9 |
150,4 |
91,0 |
247,8 |
|
AgNO3 |
CuSO4 |
LiClO4 |
NaClO4 |
KClO4 |
AgClO4 |
NaBrO4 |
KBrO3 |
|
|
133,4 |
267,2 |
106,0 |
117,5 |
140,0 |
126,6 |
105,4 |
129,3 |
|
|