|
|
|
Significations chimiques de DU et DH. Relation entre Qv et Qp à température constante. Variation de DU et DH avec la température. |
Lors d'une transformation chimique les grandeurs d'état U et H sont directement liées aux chaleurs de réaction.
L' énergie interne et l' enthalpie sont des fonctions d'état dont la signification essentielle pour un chimiste est la suivante :
La variation d'énergie interne DU au cours d'une transformation chimique correspond à la chaleur de réaction à volume constant . On la note Qv.
La variation d'enthalpie de réaction DH pour la même transformation correspond à la chaleur de réaction à pression constante Qp.
Si Q est positive la transformation est endothermique, sinon elle est exothermique
De la relation DH = DU + D(p.V) et des considérations faites au paragraphe précédent, on déduit :
Transformation avec consommation ou formation de gaz :
Si la transformation s'accompagne d'une variation Dn du nombre de moles des composés gazeux et que l'on considère ces derniers comme parfaits, la loi des gaz parfaits p.V = n. R. T s'applique et
Notez que le symbole D a la même signification quand il s'applique au nombre de moles de gaz que lorsqu'il précède une fonction d'état : il indique que Dn correspond à la variation du nombre de moles de gaz au cours de la transformation, c'est à dire à la différence entre le nombre de moles de gaz à l'état final et le nombre de moles de gaz à l'état initial.
Transformation en phase condensée :
Si la transformation s'effectue exclusivement en phase condensée (réaction entre liquides et /ou solides, réactions en solution) alors D(p.V) est très faible et voisine de zéro. On peut alors considérer que :
Pour la plupart des transformations chimiques, les ordres de grandeur des variations d'enthalpie ou d'energie interne sont de quelques centaines de kJ.mol-1, et l'ordre de grandeur de (Dn) . R. T de quelques kJ.mol-1. Il y a donc peu d'écart entre Qp et Qv et souvent, lorsque la précision recherchée n'est pas trop grande, on peut faire l'approximation Qp # Qv.
On vérifie facilement que par exemple si Dn = 1 mol, alors Qp - Qv = 1. R. T = 1 . 8,31 . 298 = 2480 J = 2,48 kJ.
Problème d'autoformation :
Vous trouverez le problème suivant dans la section s'exercer.
Pour y accéder, cliquez sur l'icône ![]() dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
exercices sont conçus pour vous apprendre à les résoudre : leur originalité
est de proposer une aide guidée très détaillée et progressive.
dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
exercices sont conçus pour vous apprendre à les résoudre : leur originalité
est de proposer une aide guidée très détaillée et progressive.
|
Détermination de la variation d'énergie interne et d'enthalpie pour une transformation Une réaction chimique est tirée au sort : on vous donne soit la variation d'énergie interne associée et vous devez trouver la variation d'enthalpie correspondante, soit l'inverse.
|
Elles découlent de l'intégration des relations suivantes :
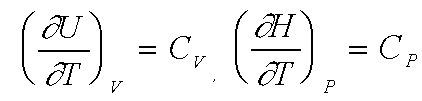
où Cv et Cp représentent les capacités calorifiques du système envisagé à volume ou à pression constante.
Ces relations sont telles que Cv représente donc la quantité de chaleur à fournir à un système pour élever sa température de 1 degré à volume constant et Cp, la quantité de chaleur à fournir à un système pour élever sa température de 1 degré à pression constante.
Nous verrons au chapître " Calcul des variations d'enthalpie lors d'une réaction chimique " comment ces relations vont être exploitées pour calculer des variations d'enthalpie ou d'énergie interne associées à une réaction donnée.