|
|
La variation d'énergie interne DU au cours d'une transformation chimique correspond à la chaleur de réaction à volume constant . On la note Qv.
La variation d'enthalpie de réaction DH pour la même transformation correspond à la chaleur de réaction à pression constante Qp.
Transformation avec consommation ou formation de gaz : Qp = Qv + Dn . R. T
Transformation en phase condensée il n'y a pratiquement pas de différence entre Qp et Qv : Qp # Qv
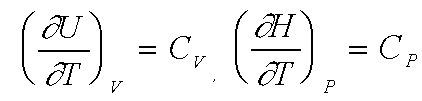
où Cv et Cp représentent les capacités calorifiques du système envisagé à volume ou à pression constante.