|
|
Enthalpie
libre.
|
Compte tenu du critère de spontaneïté d' une transformation:
Dr H - T . Dr S < 0
on a défini une nouvelle grandeur thermodynamique, fonction d'état G = H - T.S
G est l'enthalpie libre et le critère de spontanéïté d'une transformation s'écrit donc : Dr G < 0
Le potentiel chimique µi est l'enthalpie libre molaire partielle du composé i :
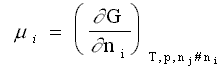
Cette définition conduit à la relation suivante permettant le calcul de l'enthalpie libre G d'un système contenant i constituants , le nombre de mol de chaque constituant étant ni :
G = Si ni µi
Le potentiel chimique d'un composé i dépend de l' activité ai du composé suivant la relation où µ°i est le potentiel chimique standard :
µi = µi° + R.T. ln ( ai )
Lorsqu'un système est à l' état d'équilibre les potentiels chimiques de tous les constituants du système sont égaux.
On peut démontrer que la différentielle de G s'écrit :
dG = V.dp - S.dT + Si µi. dni
où G représente l'enthalpie libre d'un système de volume V, d' entropie S et contenant ni mol de i constituants .
Cela veut dire qu'à température et nombre de moles constants, dG/dp = V et qu'à pression et nombre de moles constants, dG/dT = - S.