|
|
On a pu montrer que lors d'une transformation spontanée (irréversible) l'entropie macroscopique de l'univers (ensemble système + milieu extérieur ) ne pouvait qu'augmenter :
D S sys + D S ext > 0
La variation d'entropie du système DSsys se calcule à partir des tables d'entropie par différence. On sait en effet calculer DrS° à partir des tables d'entropie standard puis DS° = DrS°. x où x est l' avancement de réaction.
La variation d'entropie du milieu extérieur s'obtient , pour une transformation isotherme, par la relation :
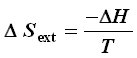
où DH correspond à la variation d'enthalpie lors de la transformation, variation qui là encore peut s'obtenir à partir des tables d' enthalpie standard de formation Df H°.
Le critère de prévision d'une transformation s'énoncera donc :
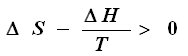
qui peut également s'écrire :
D H - T . d S < 0 et puisque D Z = Dr Z.x:
soit pour que l'avancement de réaction x soit positif, c'est à dire pour que la réaction se déroule de gauche à droite :
Cette relation est donc la condition nécessaire pour qu'une réaction chimique se déroule spontanément (de gauche à droite).