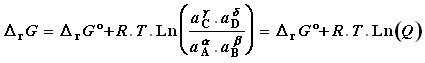|
|
|
Nous allons définir dans ce chapître une des deux grandeurs essentielles associées à une transformation chimique qui est le quotient réactionnel (Q)
Calculons l'enthalpie libre de réaction DrG pour une réaction quelconque Si ni Xi = 0 se déroulant à p et T constante :
on sait que dG = V.dp - S.dT + Si µi. dni
soit à p et T constants dG = S µi.ni dx puisque par définition dni = ni dx.
Il vient donc DrG = (dG / dx )T,p = S µi.ni
En remplaçant les potentiels chimiques par leur expression en fonction des activités, on obtient :
DrG = S µ°i.ni + R.T ln ( P aini )
où ai représente l'activité du constituant i .
En remarquant que S µ°i.ni = DrG° et en notant Q le produit des activités élevées à la puissance du coefficient stoechiométrique, P aini , il vient :
DrG = DrG° + R.T ln ( Q )
La grandeur Q = P aini sera appelée " quotient réactionnel " .
Par exemple, la variation d'enthalpie libre pour une transformation a A + b B -->g C + d D s'écrira :