|
|
C'est le nombre de paramètres intensifs qu'il est nécessaire de connaître pour décrire quantitativement le système en équilibre.
I2 (solide) <=> I2 (gaz) réaction 2
Les paramètres intensifs qui permettent de décrire l'état du système à l'équilibre seront la température T (qui impose la valeur de K) , la pression totale pt et les pressions partielles de I2, H2 et HI , pI2 , pH2 et pHI. Soit 5 paramètres intensifs.
Ces paramètres ne sont pas indépendants les uns des autres puisqu'à l'équilibre les 2 relations suivantes seront vérifiées :
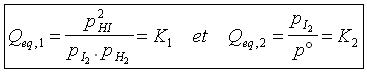
où p° représente la pression standard de référence , 1 bar .
En outre, nous aurons la relation pt = pHI + pI2 + pH2 .
Il n'existe pas de relation supplémentaire due au fait que le mélange initial soit équimolaire car I2 (gaz) est impliqué dans deux réactions. De ce fait il n'y a pas égalité entre les pressions partielles de I2 et de H2.
Ces 5 paramètres sont donc reliés entre eux par les 3 relations ci-dessus et par conséquent, la variance du système à l'équilibre vaut
v = 5 - 3 = 2.
Le nombre de paramètres intensifs qu'il est nécessaire de connaître pour définir l'état du système est donc égal à deux, donc la variance vaut donc 2.
La relation v = n + 2 - j où v est la variance, n le nombre de constituants indépendants (c.a.d. le nombre de composés chimiques concernés moins le nombre de relations entre eux) , le nombre 2 représente la pression totale pt et la température et j le nombre de phases est souvent utilisée.
Dans l'exemple ci-dessus il y a 4 constituants dans le système (I2 gaz, I2 solide, H2 et HI ) et deux transformations donc n = 4 - 2 = 2.
Le nombre de phases j = 2 (un solide et une phase gaz ) et la variance vaut donc v = 2 + 2 - 2 = 2.