|
C'est le nombre de paramètres intensifs qu'il est nécessaire de connaître pour décrire quantitativement le système en équilibre.
Les paramètres intensifs qui permettent de décrire l'état du système à l'équilibre seront la température T (qui impose la valeur de K) , la pression totale pt et la pression partielle de CO2 , pCO2 .
Ces paramètres ne sont pas indépendants les uns des autres puisqu'à l'équilibre les 2 relations suivantes seront vérifiées :
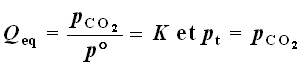
où p° représente la pression standard de référence , 1 bar .
Ces trois paramètres sont donc reliés entre eux par les deux relations ci-dessus et par conséquent, si un seul d'entre eux est imposé, l'état du système est complètement défini.
Le nombre de paramètres intensifs qu'il est nécessaire de connaître pour définir l'état du système est donc égal à un , donc la variance vaut donc un.
On retrouvera rapidement ce résultat en appliquant la relation v = n + 2 - j où v est la variance, n le nombre de constituants indépendants (c.a.d. le nombre de composés chimiques concernés moins le nombre de relations entre eux) , le nombre 2 représente la pression totale pt et la température et j le nombre de phases est souvent utilisée. Cette relation est traditionnellement appelée "règle des phases" ; elle est également connue sous le nom de loi de Gibbs.
Dans l'exemple ci-dessus il y a 3 constituants dans le système (CaCO3, CaO et CO2 ) et une réaction chimique donc n = 3 - 1 = 2.
Le nombre de phases j = 3 (2 solides et un gaz ) et la variance vaut donc v = 2 + 2 - 3 = 1.