| Chapitre 1
Concepts fondamentaux |
Équation
stoechiométrique |
|
1.1 L'équation bilan ou équation stoechiométrique.
L'équation chimique classique apporte une information à la fois :
| qualitative (quelles sont les substances qui réagissent - les réactifs - et quelles sont celles qui se forment - les produits) | |
| et quantitative (dans quelle proportion ces substances réagissent entre elles). La nature des réactifs et des produits est spécifiée par leur formule. |
La proportion avec laquelle ils réagissent est spécifiée par les coefficients stoechiométriques.
|
Exemple
:
|
L'équation bilan n'apporte aucun renseignement sur la manière dont les substances entrent en réaction au niveau moléculaire.
| Exemple
: Ainsi dans l'exemple précédent, l'équation bilan N2 + 3.H2 = 2.NH3 ne nous renseigne en rien sur les étapes de la réaction, le nombre de molécules qui entrent en contact dans chacune de ces étapes etc. |
Pour bien marquer la distinction entre
le niveau macroscopique (représenté par l'équation bilan) et le
niveau microscopique, on utilisera dans l'équation bilan le signe = pour
séparer les réactifs (conventionnellement écrits à gauche) des produits (écrits
à droite) et on réservera la flèche ![]() pour l'écriture des réactions au niveau moléculaire.
pour l'écriture des réactions au niveau moléculaire.
L'équation bilan n'indique pas le nombre de moles en présence des différentes substances. Elle spécifie seulement les proportions qui existent entre les molécules qui disparaissent (réactifs) et qui apparaissent (produits) au cours de la réaction.
b
Écriture généralisée
:
L'écriture de l'équation
bilan peut être généralisée :
|
|
|
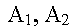 |
sont les substances initiales (réactifs) |
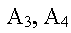 |
sont les substances formées (produits) |
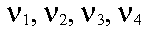 |
sont les coefficients stoechiométriques. |
Pour la suite, il est commode d'affecter conventionnellement le signe - aux coefficients des réactifs (qui disparaissent) et le signe + à ceux des produits (qui se forment). Avec cette convention, le bilan massique de la réaction complète s'écrit :
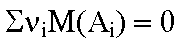
|
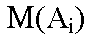 est
la masse molaire de la substance est
la masse molaire de la substance 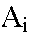 , ,
la sommation portant sur les réactifs et les produits. |
| Exemple : N2+3.H2 = 2.NH3 | |||
|
N2 |
H2 |
NH3 |
|
| Masse molaire M |
28,0 |
2,0 |
17,0 |
| Coefficients stoechiométriques affectés de leur signe n |
-1 |
-3 |
2 |
Application de l'équation
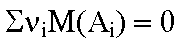 |
-1x28,0 - 3x2,0 + 2x17,0 = 0 |
||
Remarques (qui peuvent paraître évidentes mais qu'il peut être utile de rappeler...)
| Dans l'équation bilan telle qu'elle est écrite ci-dessus on ne met pas de signe aux coefficients stoechiométriques. | |
| Dans l'équation
bilan le symbole = n'a pas le même sens qu'en mathématiques; il a été introduit
conventionnellement pour remplacer la flèche |
|
| De même le symbole + utilisé dans les équations de réactions chimiques n'est pas l'opérateur d'addition ! | |
| Par contre dans l'équation du bilan massique telle qu'elle est écrite en ci-dessus, les coefficients stoechiométriques sont affectés du signe + pour les produits et du signe - pour les réactifs, la sommation est bien une sommation algébrique et le résultat est bien égal à zéro. | |
| L'équation bilan n'indique pas le nombre de moles en présence des différentes substances. Elle spécifie seulement les proportions qui existent entre les molécules qui disparaissent (réactifs) et qui apparaissent (produits) au cours de la réaction. |
Insistons :
Les quantités de substances (tant réactifs que produits) mises en présence dans un système dépendent des conditions opératoires. Lorsque ces quantités sont dans les même proportions que les coefficients stoechiométriques, on dit précisément que les réactifs sont "dans les proportions stoechiométriques". Dans le cas contraire, l'un des réactifs est en excès, l'autre est en défaut.
Généralement l'opérateur peut choisir les quantités de substances qu'il met en contact pour réaliser une réaction chimique.
S'il choisit les quantités de réactifs dans le même rapport que les coefficients stoechiométriques on dit que le mélange est "en proportion stoechiométrique" ou plus simplement on parle de "mélange stoechiométrique". Dans ce cas,
| lorsque la réaction est complète il ne restera plus de réactifs. | |
| au cours de la réaction, les réactifs restent dans les mêmes proportions. |
S'il choisit les quantités de réactifs dans un rapport différent il y aura un réactif en excès et un en défaut. Dans ce cas,
| lorsque le réactif en défaut sera entièrement consommé, la réaction s'arrêtera. | |
| au cours de la réaction, la proportion entre les réactifs évolue. |
Vous pouvez voir cela en détails
dans la rubrique ![]()