| Chapitre
1 Concepts fondamentaux |
Vitesse
de réaction |
Exemple qui illustre la notion de vitesse volumique dans le cas d'une réaction à stoechiométrie différente de 1.
Considérons par exemple la réaction :
2 NO (g) + F2 (g) = 2 NOF (g)
conduite dans un réacteur de volume fixe V .
On peut exprimer la vitesse de la
réaction par la relation de définition ![]()
en se référant à l'un quelconque des réactifs ou des produits. Le résultat
s'exprime en mol.s-1.
Le système réactionnel ayant un volume fixe V, on peut en déduire la
vitesse volumique ![]() . Le
résultat s'exprime alors en mol.L-1.s-1.
. Le
résultat s'exprime alors en mol.L-1.s-1.
Pour les réactions en solution, on emploie généralement la vitesse volumique
de préférence à la vitesse w.
Pour fixer les idées, appliquons
ces relations avec des données numériques particulières.
Application numérique
:
Le ballon dans lequel est conduite la réaction
a un volume de 400 mL.
La vitesse de la réaction a un instant t vaut : w
= 0,024 mol.s-1
Calculons la vitesse volumique de la réaction
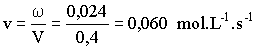
Les vitesses volumiques de transformation de chaque substance se calculent par la relation :
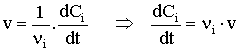
Soit pour :
| NO : | |
| F2 : | |
| NOF : |
Ces vitesses sont des grandeurs intensives dont la valeur ne dépend pas de la taille du système, alors que les vitesses de transformation exprimées en mol.s-1 sont des grandeurs extensives.
| Chapitre
1 Concepts fondamentaux |
Vitesse
de réaction |
Retour |