Vous pouvez accéder à un exemple qui traite de la vérification de l'ordre 1 à partir
|
|
du temps de demi-vie |
|
|
des vitesses |
|
|
des concentrations |
|
|
des concentrations... autre exemple. |
| Chapitre 2 Approche formelle de réactions simples |
Réaction d'ordre 1 |
Vous pouvez accéder à un exemple qui traite de la vérification de l'ordre 1 à partir
|
|
du temps de demi-vie |
|
|
des vitesses |
|
|
des concentrations |
|
|
des concentrations... autre exemple. |
Exemple de vérification de l'ordre 1 à partir du temps de demi-vie :
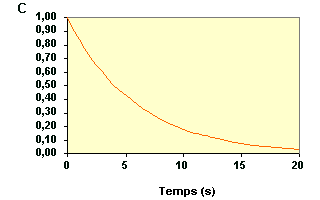 |
La variation de concentration du réactif A au cours du temps d'une réaction est représentée sur cette figure. |
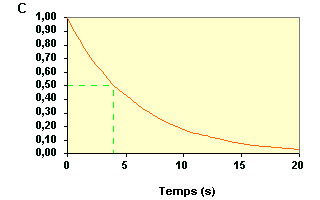 |
Donc la première période : t 1/2 = t1 = 4 s |
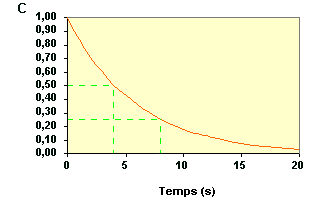 |
Déterminons la date qui correspond
à C = 0,25. On trouve t2 = 8,2 s.
La deuxième période vaut donc : On peut considérer que ces deux valeurs (4,0 et 4,2) sont sensiblement égales. |
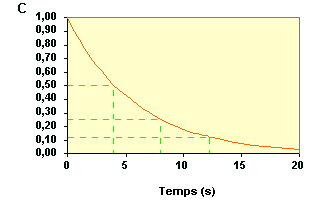 |
Cherchons à le confirmer en
déterminant la date pour C = 0,125. On trouve : t3 = 12,2 s . La troisième période vaut donc :
Ainsi, la valeur du temps de demi-vie déterminée pour différentes concentrations est sensiblement constante t1 = 4,0 s ; t2 - t1 = 4,2 s et t3 - t2 = 4,0 s. Ceci permet de conclure que la réaction obéit à une loi d'ordre 1. |
| Remarque
: Dans cet exemple, les temps de demi-vie sont très voisins. Il peut se faire que, compte tenu des erreurs expérimentales, on trouve des temps de demi-vie légèrement différents bien que la réaction soit du premier ordre. |
|
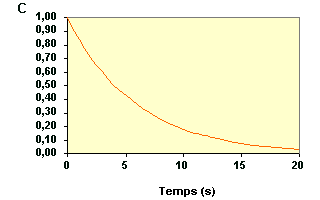
Exemple de vérification
de l'ordre 1 à partir des vitesses :
|
A partir de cette courbe, on peut déterminer graphiquement, la vitesse de la réaction pour différents instants. |
| On a trouvé les résultats suivants : | ||||||||
|
t (s) |
2 |
4 |
6 |
8 |
10 |
12 |
16 |
20 |
|
v mol.L-1.s-1 |
0,121 |
0,086 |
0,061 |
0,044 |
0,031 |
0,022 |
0,011 |
0,006 |
|
Pour chaque point, on relève aussi la concentration, que l'on porte dans le même tableau. |
||||||||
|
t (s) |
2 |
4 |
6 |
8 |
10 |
12 |
16 |
20 |
|
v mol.L-1.s-1 |
0,121 |
0,086 |
0,061 |
0,044 |
0,031 |
0,022 |
0,011 |
0,006 |
|
C mol.L-1 |
0,071 |
0,051 |
0,036 |
0,026 |
0,018 |
0,013 |
0,007 |
0,003 |
|
On peut faire la vérification
de la relation v = k. CA soit numériquement, soit graphiquement. |
||||||||
|
t (s) |
2 |
4 |
6 |
8 |
10 |
12 |
16 |
20 |
|
k s-1 |
1,70 |
1,69 |
1,69 |
1,69 |
1,72 |
1,69 |
1,57 |
2,00 |
|
On observe que pour les derniers points les valeurs s'écartent de celles obtenues pour les premiers points ; il est facile de voir que la précision sur ces deux derniers points est sensiblement moins grande. |
||||||||
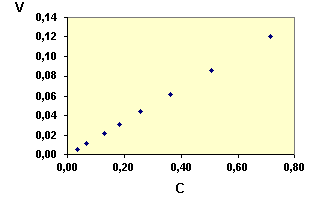 |
De manière graphique, on porte v en fonction de CA et on constate que les points s'alignent bien sur une droite passant par l'origine |
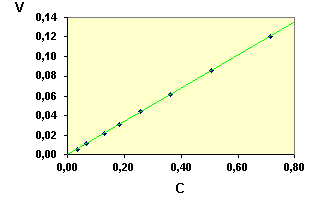 |
La droite passant par ces points On trouve une pente égale à : |
|
Remarque
: |
|
Exemple de vérification
de l'ordre 1 à partir des concentrations :
| La variation de concentration du réactif A au cours du temps d'une réaction est représentée sur la figure ci-dessous : | |
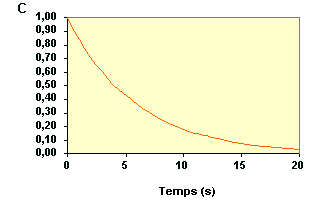 |
La loi de
vitesse sous sa forme intégrée s'écrit :
En portant |
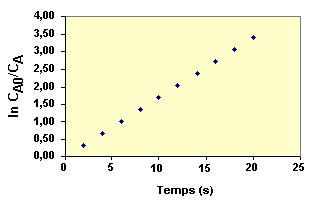 |
|
Autre exemple de vérification de l'ordre 1 à partir des concentrations :
| La variation de concentration du réactif A au cours du temps d'une réaction est représentée sur la figure ci-dessous : | |
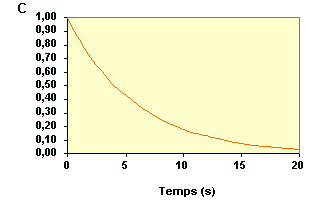 |
La loi de vitesse
|
| On peut
donc calculer la valeur de k pour chaque point par la relation :
Avec 10 points de la courbe précédente,
|
|
|
Remarque
: |
|