|
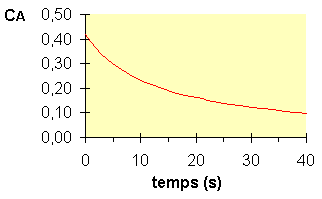
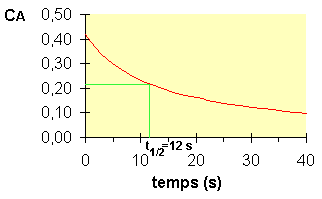
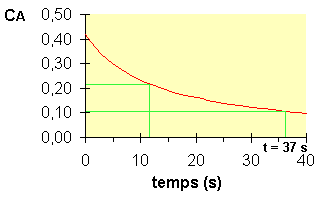
On a effectué trois expériences
avec des concentrations initiales différentes et on a mesuré le temps
de demi-vie pour chacune d'elles. |
||||||||||||
|
||||||||||||
|
On constate immédiatement que le temps de demi-vie varie avec la concentration initiale, la réaction n'est donc pas du premier ordre. Pour vérifier si elle est
du second ordre, |