| Chapitre 2 Approche formelle de lois de vitesse d'ordre simple |
Réactions
d'ordre global deux |
2.3
Réaction d'ordre global 2 :
Réactions qui obéissent à une loi
de vitesse ![]() ou
ou ![]()
suivant que l'ordre est 2 par rapport à un réactif
ou que l'on a un ordre partiel 1 pour deux réactifs.
| Réactions
d'ordre global deux |
Ordre
2 par rapport à un seul réactif |
2.3.1
Ordre 2 par rapport à un seul réactif.
Loi de vitesse
Par définition, la vitesse de la réaction s'écrit :
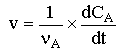
Pour une réaction
du type 2.A = P n A =
- 2
La loi de vitesse étant d'ordre 2 par
rapport à A on peut écrire :
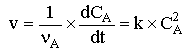
qui s'intègre en
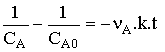
avec nA = - 2 d'où
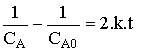 ( k en L mol-1 s-1 )
( k en L mol-1 s-1 ) |
De l'expression précédente, on tire facilement la relation qui permet de calculer la concentration de A à un instant t :
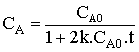 |
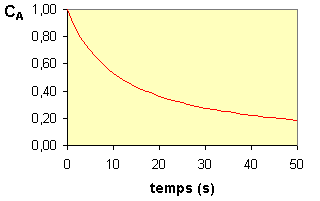
La variation de CA au cours du temps est représentée sur la figure ci-dessous :
Cliquez
ici pour une comparaison des variations CA
pour des réactions d'ordre 1 et d'ordre 2.
Cliquez ici
pour lire une remarque concernant l'écriture de l'équation bilan.
Cliquez ici
pour examiner d'autres formes de la loi de vitesse.
Temps de demi-vie.
Le temps de demi-vie se déduit de
la loi de vitesse intégrée en posant ![]() d'où :
d'où :
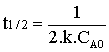 |
Pour une réaction d'ordre 2, le temps de demi-vie est donc inversement proportionnel à la concentration. Voir figure ci-contre :
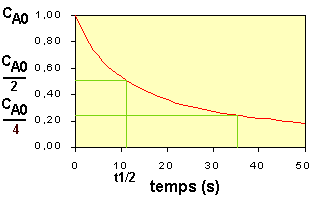
Le temps de demi-vie d'une réaction du second ordre est inversement proportionnel à la concentration du réactif.
 |
Cette
observation n'est pas sans conséquences en ce qui concerne la dégradation
de substances toxiques dans l'environnement.
Les substances qui se décomposent suivant une réaction du second ordre mettront beaucoup plus de temps pour s'éliminer que celles qui subissent des dégradations du premier ordre. |
Vérification de l'ordre 2.
Position du problème
:
On étudie une réaction et on désire s'assurer qu'elle
suit une loi du second ordre.
Si c'est bien le cas, on désire généralement déterminer la valeur du coefficient
de vitesse. Dans ce qui suit, on examineraseulement le cas d'un ordre deux
par rapport à un seul réactif. Le cas des réactions d'ordre global deux
faisant intervenir deux réactifs avec un ordre partiel égal à un pour chacun
d'eux est traité dans le paragraphe suivant.
On peut effectuer cette vérification à partir :
| des valeurs des temps de demi-vie, | |
| des valeurs des vitesses correspondantes à différentes concentrations, | |
| des valeurs de concentrations mesurées au cours du temps. |
Vérification
de l'ordre 2
à partir des valeurs
des temps de demi-vie :
Le temps de demi-vie d'une réaction
du second ordre est inversement proportionnel à la concentration du réactif.
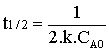
On peut vérifier qu'une réaction
est d'ordre deux en s'assurant que, pour plusieurs concentrations
CA0
, le
produit ![]() est constant.
est constant.
Remarque :
Cette vérification peut porter sur plusieurs expériences
effectuées avec des concentrations initiales différentes, ou sur une expérience
au cours de laquelle on a déterminé plusieurs valeurs du temps de demi-vie.
Vous pouvez voir des exemples...
Vérification
de l'ordre 2
à partir des valeurs
des vitesses correspondantes à différentes concentrations :
Par définition, la vitesse d'une
réaction du second ordre s'écrit : ![]()
On peut donc vérifier qu'une réaction est d'ordre deux en s'assurant que sa vitesse est proportionnelle au carré de la concentration.
Remarque :
Cette vérification peut porter sur plusieurs expériences
effectuées avec des concentrations initiales différentes (dans ce cas on utilise
souvent les vitesses initiales), ou sur une seule expérience au cours de laquelle
on a déterminé la vitesse et la concentration à différents instants.
Vous pouvez voir des exemples...
Vérification
de l'ordre 2
à partir des valeurs
de concentrations mesurées au cours du temps :
La forme intégrée de la loi de vitesse
du second ordre s'écrit :
On peut donc vérifier qu'une réaction est d'ordre deux en s'assurant que les valeurs de la concentration, mesurées au cours du temps, suivent bien cette relation.
Remarque :
Cette vérification peut se faire de manière numérique,
en calculant pour chaque couple CA,t la valeur du coefficient de
vitesse et en s'assurant qu'elle est constante, ou de manière graphique,
en traçant 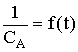 qui doit donner une droite.
qui doit donner une droite.
Vous pouvez voir des exemples...
| Réactions
d'ordre global deux |
Ordre partiel
1 par rapport à deux réactifs |
2.3.2 Ordre partiel 1 par rapport à deux réactifs.
Dans une première
approche on se limite ici au cas des réactions du type : A
+ B = Produits avec ![]()
donc d'ordre global 2 et d'ordre 1 par rapport à chaque réactif.
Loi de vitesse :
On distingue deux cas : celui pour lequel les concentrations initiales sont différentes et le cas particulier simple qui se présente lorsque les concentrations initiales sont égales CA0 = CB0
Dans
le cas particuler pour lequel les concentrations sont égales,
les concentrations au cours du temps restent alors égales CA = CB et
la loi de vitesse est la même que précédemment : ![]() d'où
la même expression intégrée.
d'où
la même expression intégrée.
A savoir :
k en L mol-1 s-1
Lorsque les concentrations initiales sont différentes : CA0 différent de CB0
En posant x
la concentration transformée à un instant t,
les concentrations courantes s'écrivent en fonction des concentrations initiales
: ![]() et
et ![]()
La vitesse de réaction
: ![]() est égale à
est égale à ![]()
d'où l'expression de la loi de vitesse sous sa forme différentielle qui s'intègre
en 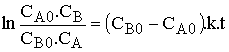
Cliquez
ici pour voir des
détails sur l'intégration.
| Chapitre 2 Approche formelle de lois de vitesse d'ordre simple |
Fin. |