| Bien que ce soit d'un
usage moins fréquent, on peut aussi déterminer la vitesse à plusieurs
instants d'une seule expérience.
Nous avons vu dans la quatrième partie
|
|||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||
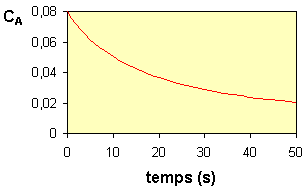
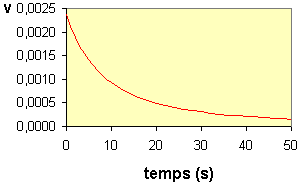
En relevant les valeurs de
la vitesse et de la concentration à divers instants, on peut dresser
le tableau suivant :
Pour vérifier que ces valeurs sont en
accord avec la loi du second ordre
|
|||||||||||||||||||||||||
| Cliquez
ici pour voir une solution numérique... Cliquez ici pour voir une solutin graphique... |