|
INFLUENCE DE LA COMPLEXATION SUR LA SOLUBILITE DE CERTAINS COMPOSES IONIQUES.
Si les ions libérés lors de la dissolution dans l’eau d’un composé ionique peuvent réagir avec le solvant par des réactions acido-basiques, ces ions peuvent également être impliqués dans des réactions de types différents, comme par exemple des réactions de complexation. L’existence de ces réactions ayant pour conséquence de modifier la concentration des ions libérés, ces réactions vont également modifier la solubilité la solubilité d’un composé.
L’addition d’une solution concentrée d’ammoniac NH3 à un milieu dans lequel on observe un précipité d’hydroxyde de cuivre(II) Cu(OH)2 (s) a pour conséquence la disparition du précipité et le changement de couleur de la solution :
| Précipitation de l'hydroxyde de cuivre et redissolution par complexation |
Cette disparition du précipité s’explique par l’existence de la réaction :
Cu2+ + 4 NH3 ó
Cu (NH3)42 + K >> 1qui
entraîne une diminution considérable des la concentration des ions Cu2+ ;
de ce fait, le quotient réactionnel Q associé à la réaction
Les hydroxydes solides de certains métaux précipitent en milieu neutre ou faiblement basique et « disparaissent » en milieu basique concentré ! Ces hydroxydes sont appelés des hydroxydes amphotères car ils peuvent réagir à la fois comme des acides et comme des bases ; ainsi, l’hydroxyde M(OH)x du métal M sera amphotère s’il réagit avec l’eau suivant une réaction du type :
![]()
et s’il réagit avec les ions hydronium suivant une réaction du type :
![]()
Les ions Zn2+ et Al3+ vont former des hydroxydes amphotères contrairement aux ions Fe2+ et Fe3+ :
| Précipitation de l'hydroxyde d'aluminium et redissolution par complexation |
Les ions Zn2+ réagissent avec les ions hydroxyde d’une solution suivant la réaction :
![]()
Tant que le quotient réactionnel Q1 = [Zn2+].[OH-] 2< Ks le précipité n’apparaît pas ; lorsque la concentration des ions hydroxyde est suffisante, c’est à dire au delà d’un certain pH on observe le précipité.Si l’on augmente encore le pH, par exemple en ajoutant une quantité notable de base forte très soluble comme la soude Na+ + OH-,une nouvelle réaction supplante le processus de précipitation :
![]()
Considérons une solution contenant des ions Zn2+ totalement dissous (en milieu acide) à la concentration de 0,010 mol.L-1 et ajoutons une solution de soude concentrée à cette solution ; la solubilité s du zinc va correspondre à la somme des concentrations des espèces solubles, c’est à dire s = [Zn2+] + [Zn (OH)42-].
Dès l’apparition du précipitéZn (OH)2(s), la relation Ks
= [Zn2+].[OH-]2 est vérifiée ; de même,
la présence de la réaction 2,![]() ,
,
implique l’existence de la relation :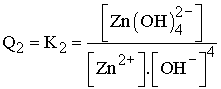
On en déduit : 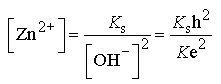
en notant : ![]() et
et 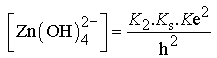 soit
soit
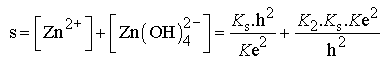
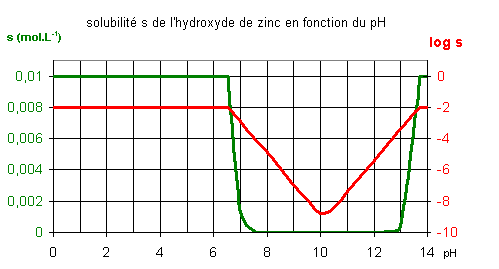
Les deux courbes ci-dessus représentent l’évolution de la quantité d’hydroxyde de zinc dissout dans un litre de solution en fonction du pH lorsque la concentration en ion Zn2+ est au maximum 0,01 mol.L-1. On constate que l’hydroxyde précipite pour un pH supérieur à 6,5 et se redissout totalement lorsque le pH devient supérieur à 13,7. La courbe rouge présentée en échelle logarithmique permet de constater que la quantité de précipité de Zn(OH)2 est maximale pour pH = 10.
|