|
INFLUENCE DE LA COMPLEXATION SUR LA SOLUBILITE DE CERTAINS COMPOSES IONIQUES.
Si les ions libérés lors de la dissolution dans l’eau d’un composé ionique peuvent réagir avec le solvant par des réactions acido-basiques, ces ions peuvent également être impliqués dans des réactions de types différents, comme par exemple des réactions de complexation. L’existence de ces réactions ayant pour conséquence de modifier la concentration des ions libérés, ces réactions vont également modifier la solubilité la solubilité d’un composé.
Disparition d’un précipité d’hydroxyde de cuivre en présence d’ammoniac.
L’addition d’une solution concentrée d’ammoniac NH3 à un milieu dans lequel on observe un précipité d’hydroxyde de cuivre(II) Cu(OH)2 (s) a pour conséquence la disparition du précipité et le changement de couleur de la solution :
La section détaillée montre une video illustrant ce phénomène ; elle fournit aussi les explications nécessaires.
Précipitation et redissolution des hydroxydes métalliques
Les hydroxydes solides de certains métaux précipitent en milieu neutre ou
faiblement basique et « disparaissent » en milieu basique concentré !
Ces hydroxydes sont appelés des hydroxydes amphotères car ils peuvent réagir
à la fois comme des acides et comme des bases ; ainsi, ainsi, les ions Zn2+
et Al3+ vont former des hydroxydes amphotères contrairement
aux ions Fe2+ et Fe3+ :
La section détaillée montre une video
illustrant ce phénomène ; elle fournit aussi les explications
nécessaires.
Dans le cas de l'ion zinc, la solubilité s dépend du produit de solubilité Ks, de la constante de complexation de Zn2+ par les ions hydroxyde K2 et de la concentration h en ions hydronium :
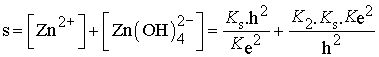
Le détail des calculs et leur exploitation est présentée dans la section " détaillée "