|
INFLUENCE DU pH SUR LA SOLUBILITE DE CERTAINS COMPOSES IONIQUES
Lorsqu’un des ions d’un composé ionique possède des propriétés acides ou basiques, le fait d’imposer (par exemple en utilisant une solution tampon) le pH du milieu dans lequel on dissout ce composé va modifier sa solubilité.
Cela explique la redissolution de certains précipités quand on ajoute une petite quantité d’acide ou de base au milieu dans lequel ils se trouvent.
Exemples de composés dont la solubilité varie avec le pH.
Ce sont les composés dont l’un des ions possède un caractère acide ou basique.
Solubilité de l’éthanoate d’argent en fonction du pH.
Les calculs de la solubilité s de ce composé en fonction du pH sont développés dans la section " détaillée " ; ils donnent les résultats suivants :
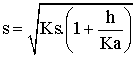
Solubilité du sulfure de manganèse MnS en fonction du pH.
Les calculs sont un peu plus complexes quand l'anion possède deux fonctions acido-basiques, comme l'ion sulfure.
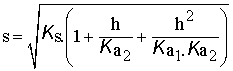
Dans de nombreux cas, des réactions de complexation peuvent également se produire, comme par exemple dans le cas de nombreux hydroxydes ; la solubilité des hydroxydes sera étudiée au paragraphe suivant.