|
|
L' entropie sera une fonction croissante de la température ; la dérivée de l'entropie par rapport à la température est dS / dT = Cp / T .
Il vient donc pour une mole de solide pur dans son état standard :
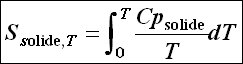
cela si le composé i reste à l'état solide dans l'intervalle de température de 0 à T K.
Si au contraire le composé i passe à l'état liquide à Tfus K et bout à Teb K, alors il vient :
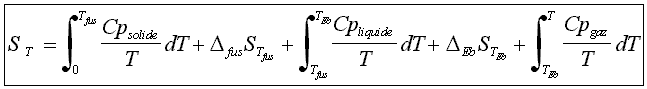
où DfusSTfus = entropie de fusion = DfusHTfus / Tfus
et DebSTeb = entropie d'ébullition = DebHTeb / Teb .
L'animation ci-dessous illustre cette variation dans le cas de l'eau pure :
Vous trouverez la simulation suivante dans la section simuler. Pour y accéder,
cliquez sur l'icône ![]() dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
simulations sont toujours interactives.
dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
simulations sont toujours interactives.
|
Variation d'entropie du méthane en fonction de la température Le simulateur calcule pour vous l'entropie du méthane à la température que vous avez choisie. Il vous explique très en détail comment les calculs ont été effectués. |