|
|
|
Le calcul de K à une température T passe soit par celui de DrG° à cette même température soit par celui de K à 298K et l'exploitation de la loi de Van t'Hoff. Les paragraphes précédents expliquent comment on calcule DrG°celui ci comment on peut calculer K si l'on connait K298.
La valeur de K à la température T se déduit de la relation :D rG°T = - R.T ln( KT )
Il est donc facile d'obtenir K à partir des valeurs de DrG°T .... mais assez long de calculer DrG°T .
Il est souvent aussi commode de calculer KT à partir de K298 en intégrant la loi de Vant'Hoff :
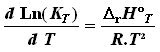
L'intégration de cette dernière relation entre 298 K et une température quelconque T conduit à :
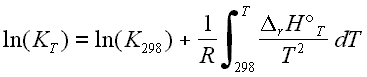
DrH°T étant obtenu par intégration de la loi de Kirchhoff et
K298 à partir de DrG°298 = - R.298 ln( K298 ) = DrH°298 - 298 .D rS°298
Une approximation courante consiste à assimiler DrH°T à DrH°298 dans la relation de Van t'Hoff.
Vous trouverez le problème suivant dans la section s'exercer.
Pour y accéder, cliquez sur l'icône ![]() dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
exercices sont conçus pour vous apprendre à les résoudre : leur originalité
est de proposer une aide guidée très détaillée et progressive.
dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
exercices sont conçus pour vous apprendre à les résoudre : leur originalité
est de proposer une aide guidée très détaillée et progressive.
Calcul d'une constante d'équilibre associée à une réaction chimique à une température quelconque à partir des tables de données thermodynamiques.Vous disposez des tables thermodynamiques d'enthalpie standard de formation à 298K, d'entropie standard à 298K ainsi que des capacités calorifiques molaires en fonction de la température pour de nombreux composés.Vous devez calculer la constante d'équilibre associée à une réaction tirée au sort à partir de ces données. Vous avez le libre choix de la méthode d'approximation, c'est à dire de la difficulté des calculs... |
Vous trouverez la simulation suivante dans la section simuler. Pour y accéder,
cliquez sur l'icône ![]() dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
simulations sont toujours interactives.
dans le bandeau de
gauche et choisissez le chapitre correspondant dans la table des matières. Ces
simulations sont toujours interactives.
Simulateur
permettant le calcul d'une constante d'équilibre à une température
quelconque
Ce simulateur vous permet de choisir une réaction chimique dans une liste et de faire calculer la constante d'équilibre correspondante à n'importe quelle température en utilisant à votre choix l'approximation d'Ellingham ou la loi de Van t'Hoff avec des Cp constants ou variant linéairement avec la température. Vous avez également la possibilité de visualiser graphiquement les résultats de ces calculs et donc de comparer ces différentes méthodes d'approximation.Il est conseillé d'utiliser ce simulateur aprés avoir effectué l'exercice précédent. |