| Chapitre
5 Réactions composées... |
Réactions opposées... |
5.2 Les réactions opposées.
Les réactions opposées (dites aussi réactions incomplètes)
sont constituées de deux réactions dont les réactifs de l'une sont les produits
de l'autre.
D'une manière générale, chacune des deux
réactions peut avoir un ordre quelconque et faire intervenir plusieurs réactifs
et produits, cependant, pour simplifier, nous nous limiterons à l'étude de deux
réactions opposées d'ordre 1.
On peut les schématiser par :
![]()
que l'on écrit souvent

Ces réactions correspondent aux cas, relativement fréquents, où la réaction peut avoir lieu dans les deux sens. La réaction ne peut pas être complète dans un sens, le système évolue donc vers un état d'équilibre dont on peut prévoir la composition par la thermodynamique. Les termes de réactifs et de produits perdent un peu de leur signification si on opère dans des conditions où toutes les entités réagissantes sont initialement présentes. L'équation bilan peut être écrite dans les deux sens et reste respectée à toute instant.
5.2.1 Réactions opposées d'ordre 1.
On appelera réaction directe la réaction
![]() et
réaction inverse la réaction
et
réaction inverse la réaction ![]() tout en remarquant que ce choix est arbitraire et que les termes de réactifs
et de produits sont conventionnels et sont fixés par le choix des concentrations
initiales en A et B.
tout en remarquant que ce choix est arbitraire et que les termes de réactifs
et de produits sont conventionnels et sont fixés par le choix des concentrations
initiales en A et B.
5.2.1.a Approche qualitative.
Avant d'aborder l'étude analytique
de la loi de vitesse, il est utile de se familiariser avec le comportement qualitatif
du système cinétique.
Considérons pour commencer seulement la réaction directe ![]() d'ordre 1.
d'ordre 1.
Soit k1 son coefficient de vitesse et CA0 la concentration initiale
en A.
La réaction est complète, au bout d'un certain temps, il ne reste pratiquement
plus de réactif A qui s'est entièrement transformé en B.
La réaction n'est donc pas complète, on atteint un état d'équilibre lorsque les vitesses des réactions directes et inverses sont égales, v1 = v2
D'où : k1.CA¥
= k-1.CB¥.
Avec CA¥ et CB¥
respectivement les concentrations de A et de B à l'équilibre.
Qui s'écrit aussi : 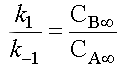
Dans le cas particulier considéré ci dessus où k1 = k-1., on a évidemment CA¥ = CB¥
Considérons maintenant le cas ou k1
> k-1.
Par exemple k1 = 0,6 s-1 (inchangé
par rapport à ce qui précède) et k-1
= 0,2 s-1.
En appliquant la relation précédente, il vient
: 
D'où CB¥
= 3.CA¥
Comme CA0 + CB0 = CA + CB = CA¥
+ CB¥ = 1,0 mol L-1.
Il vient aisément : CA¥
= 0,25 mol.L-1 et CB¥=
0,75 mol.L-1 .
On obtient les courbes de variation des concentrations suivantes

Notez que les courbes se coupent lorsque
CA = CB c'est-à-dire
à CA=CB = 0,5 mol.L-1.
L'équilibre est quasiment atteint au bout de 7 ou 8 secondes.
Considérons maintenant le cas ou k1
< k-1.
Par exemple, k1 = 0,6 s-1 (inchangé
par rapport à ce qui précède) et k-1
= 1,8 s-1.
En procédant comme précédemment, on trouve CA¥ = 0,75 mol.L-1 et CB¥ = 0,25 mol.L-1. Cliquez ici pour voir les détails du calcul.
On obtient les courbes de variation des concentrations suivantes :
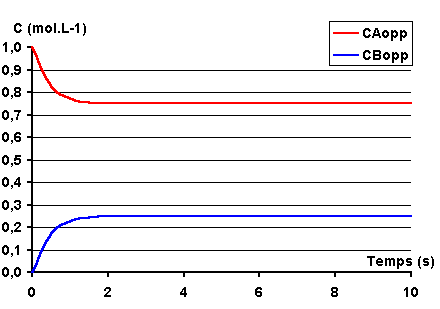
On note, que dans ce cas les courbes
CA et CB ne se coupent pas.
En effet, la concentration à l'équilibre
de A, CAeq est inférieure à 0,5 mol.L-1 à aucun moment
CA = CB.
Notez également que l'équilibre est atteint
plus rapidement que dans le cas précédent (au bout de 2 secondes environ). Cela
vient du fait que la somme k1 + k-1
est supérieure à la valeur qu'elle avait dans le cas précédent. Ce point sera
explicité lors de l'étude analytique de la loi de vitesse.
5.2.1.b Etude analytique de la loi de vitesse.
Soient v1 et v-1
les vitesses et k1 et k-1
les coefficients de vitesses des réaction directe et inverse.
Au temps t = 0 les concentrations initiales de A et B sont CA0 et CB0.
Posons x la concentration de A transformée à l'instant t.
Les concentrations courantes à cet instant t sont : CA = CA0
- x et CB = CB0 + x
La vitesse des réactions directe et inverse considérées isolément s'écrivent :
v1 = k1.CA v-1 = k-1.CB.
La vitesse globale de la réaction (définie comme étant la vitesse de disparition de A) est égale à :
v = - dCA / dt = v1 - v-1
en effet A disparaît par la réaction
directe, mais se reforme par la réaction inverse.
Puisque la vitesse globale est définie comme étant la vitesse de disparition
de A, il faut compter positivement v1 et négativement v-1.
D'où
v = - dCA /
dt = v1 - v-1 = k1.CA
- k-1.CB
et v = - dCA
/ dt = k1.(CA0 - x) - k-1.(CB0
+ x) = dx / dt
Notez qu'on aboutit à la même expression
si on définit la vitesse de la réaction comme étant égale à la vitesse de formation
de B.
En effet,
v = - dCA /
dt = dx / dt car CA
= CA0 - x
v = dCB / dt
= dx / dt car CB
= CB0 + x
La loi de vitesse sous sa forme différentielle est donc
dx / dt = k1.(CA0 - x) - k-1.(CB0 + x)
ln ( x¥ / (x¥ - x) ) = ( k1 + k-1 ).t
Cliquez ici pour voir les détails sur l'intégration de la loi de vitesse.
Remarques :
5.2.1.c Influence des valeurs des coefficients de vitesse sur le régime cinétique.
Voyons de nouveau quelques situations typiques :
Influence du rapport k1 / k-1, la somme k1 + k-1 étant maintenue constante.
5.2.1.d Influence des concentrations initiales sur le régime cinétique.
Dans les exemples qui précèdent nous avons considéré
que la concentration initiale en B était nulle.
Il est évident que l'opérateur a le choix des concentrations initiales.
En particulier il est (du moins en principe)
possible d'étudier la réaction en partant du produit B et en prenant CA0
= 0.
Les rôles de A et de B se trouvent alors inversés. B peut alors être considéré
comme le réactif et A comme le produit. Les graphes suivants représentent
les variations de concentrations obtenues pour des mêmes valeurs des coefficients
de vitesse quand on intervertit les concentrations initiales de A et B.
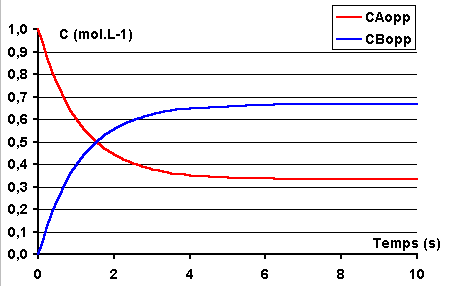 |
K1 = 0,6 s-1 |
 |
K1 = 0,6 s-1
K-1 = 0,3 s-1 CAO = 0,0 mol.L-1 CB0 = 1,0 mol.L-1 |
Les coefficients de vitesse étant les mêmes, on obtient évidemment le même état d'équilibre. Mais les concentrations initiales étant permutées, dans un cas les courbes se coupent, dans l'autre non.
Il est également possible de démarrer la réaction
avec un mélange de A et de B.
Pour illustrer les conséquences sur le régime cinétique, nous tracerons quelques
graphes pour les mêmes valeurs de : K1 et K-1
en faisant varier le rapport CAO / CB0 tout
en maintenant la somme CAO + CB0 constante
et égale à 1 mol.L-1.
On constate que lorsque les concentrations
initiales se rapprochent des concentrations dans l'état d'équilibre, la réaction
est de moins en moins importante.
Plus précisément x¥
= CA0 - CA¥ tend
vers 0.
x¥ représente en quelque
sorte la concentration de A "transformable", on l'appelle parfois la concentration
"cinétiquement active".
Lorsque les concentrations initiales sont égales aux concentrations à l'équilibre, c'est-à-dire lorsque x¥ = 0, l'état d'équilibre est établit d'emblée et il n'y a pas de réaction décelable au niveau macroscopique.
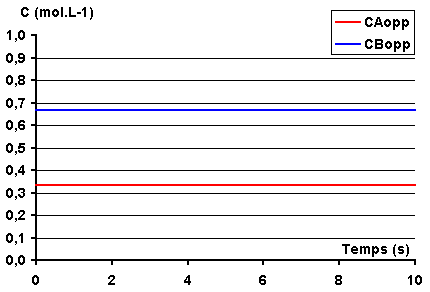 |
|
K1 =
0,6 s-1 K-1 = 0,3
s-1
CAO = 0,33 mol.L-1 CB0 = 0,66 mol.L-1 |
5.2.1.e Remarques sur l'état d'équilibre.
Remarque 1 : Nature de l'état d'équilibre.
L'état d'équilibre atteint par le
système au bout d'un certain temps est un équilibre dynamique.
Au niveau macroscopique, la composition du système ne varie plus.
Cependant au niveau microscopique, la réaction ne s'est pas arrêtée.
Pendant chaque intervalle de temps, un certain nombre de molécules de A se
transforment en molécules de B. Dans le même temps, un nombre égal de molécules
de B se transforment en molécule de A. Les vitesses des réactions directes
et inverses sont égales.
|
Simulateur
|
Cet état d'équilibre dynamique ne doit pas être confondu avec un mélange inerte. Dans un mélange inerte, la composition du système ne varie évidemment pas, elle est fixée par les quantités de constituants introduits dans le mélange. Dans un équilibre dynamique, la composition n'évolue pas, précisément parce qu'on est dans l'état d'équilibre. La composition dépend de la valeur de la constante d'équilibre et des concentrations initiales des réactifs.
Remarque 2 : Perturbation de l'état d'quilibre (approfondissement)...
Remarque 3 : Relation entre coefficients de vitesse et constante d'équilibre.
Lorsque l'équilibre est atteint,
les vitesses des réactions directes et inverses sont égales.
Ce qui s'exprime par : v1 = k1.CA¥
= v-1 = k-1.CB¥
d'où 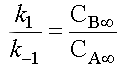 .
.
Or le rapport CB¥ / CA¥ n'est autre que la constante d'équilibre exprimée en concentration Kc
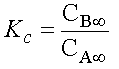 d'où
d'où
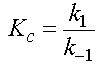 .
.
Nota : s'agissant d'un rapport sans dimension, ce rapport est aussi égal à la constante thermodynamique d'équilibre K et à la constante d'équilibre exprimée en pression, Kp, puique dans ces conditions, les valeurs de ces trois constantes sont égales.
Rappel : la valeur de la constante thermodynamique d'équilibre KT à une température donnée T, se calcule à partir de la variation d'enthalpie libre de référence de la réaction à la même température DRG°T par la relation: RT . lnKT = - DRG°T .
5.2.1.f Traitement des données expérimentales.
L'objectif est double :
Selon les données dont on dispose,
on utilise la loi de vitesse sous sa forme différentielle
ou sous sa forme intégrée.
v = - dCA / dt = v1 - v-1 = K1.CA - K-1. CB
Pour utiliser la loi de vitesse sous cette forme, il faut disposer de plusieurs valeurs de la vitesse de réaction pour diverses valeurs des concentrations CA et CB.
Un cas particulièrement simple se présente si on a mesuré les vitesses initiales et que l'on a fait deux séries d'expériences, l'une avec CA0 différent de 0 et CB0 = 0, l'autre avec CA0 = 0 et CB0 différent de 0. La première série permet de déterminer k1, la seconde k-1.
On peut aussi mesurer la vitesse et les concentrations CA et CB au cours du temps sur une seule expérience. Il en résulte une série de relations que l'on résout pour déterminer k1 et k-1 L'utilisation des vitesses est simple, mais donne des résultats assez peu précis, car la détermination des vitesse (souvent effectuée par dérivation graphique des courbes concentration / temps) est délicate et imprécise.
Vous pouvez voir des exemples...
Vous pouvez faire un exercice...
La forme intégrée de la loi de vitesse s'écrit :
ln ( x¥ / (x¥ - x) ) = ( k1 + k-1 ).t
avec x¥ = CA0 - CA¥
et
On détermine d'abord x¥ à partir de CA0 et CA¥.
Notez que, dans certain cas, la composition à l'équilibre, donc CA¥, peut être connue ou déterminée séparément.
Puis on vérifie la relation ln ( x¥ / (x¥ - x) ) = ( k1 + k-1 ).t soit par une méthode graphique, soit en vérifiant que la valeur de k1 + k-1 calculée pour une série de points est constante. Enfin, connaissant k1 + k-1 et le rapport k1 / k-1 (par la composition à l'équilibre), on calcule séparément les valeurs de chaque coefficient de vitesse.Vous pouvez voir des exemples...
Vous pouvez faire un exercice...
5.2.1.g Exemples de réactions.
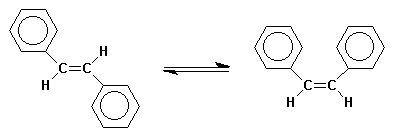
Enolisation d'une b-dicétone en système conjugué :
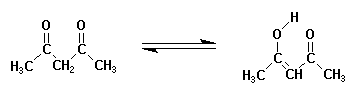
Isomérisation E / Z du 1,2-biphényle éthylène :
| Chapitre
5 Réactions composées... |
Réactions parallèles... |