Classement des acides (ou bases) forts ou faibles dans l’eau
1 – Réaction d’un acide A dans l’eau pure.
Dans l'eau pure, les 2 espèces conjuguées de H2O,
H3O+ et OH-, sont elles-mêmes respectivement
un acide et une
base. Ces deux ions sont donc associés à deux
couples
acide - base et donc à deux constantes
d’acidité.
La réaction d’acidité d’un acide A
appartenant au couple A / B
est
A + H2O Û B + H3O+
La réaction d’acidité de l’acide H3O+ appartenant au couple H3O+ /H2O sera donc :
H3O+ + H2O Û H2O + H3O+
Cette réaction d’acidité a une constante d’acidité
égale à 1 car le quotient réactionnel Q associé
à cette réaction vaut 1 puisque les composés formés
sont identiques aux réactifs consommés.
On a donc pour l’acide H3O+ Q = Ka
= 1 ou encore pKa = 0
2 - Acides forts et acides faibles.
Considérons un acide A correspondant
à un couple Acide-base de pKa < 0 (Ka > 1).
D’après les lois de la thermodynamique, cela signifie que la réaction
A + H2O Û
B + H3O+ se déplace spontanément vers la
droite dans les conditions standards (DrG0
< 0).
Pour les concentrations en acide habituellement rencontrées c’est
à dire pour des concentrations nettement inférieures à
1 mol.L-1, on peut montrer alors que la réaction est quasi
totale.
Un acide A appartenant à un couple acide-base de pKa négatif
sera donc totalement transformé en ions H3O+ :
on dit qu’il s’agit alors d’un acide fort.
Un
acide A appartenant à un couple acide-base de pKa positif ne sera que
partiellement transformé en ions H3O+ : on
dit qu’il s’agit alors d’un acide faible.
Conséquences (pour les concentrations habituelles : << 1 mol.L-1) :
3 – Réaction d’une base dans l’eau.
La réaction de basicité d’une base B appartenant au couple A / B est
B + H2O Û A + OH-.
La réaction de basicité de la base OH- appartenant au couple H2O / OH- sera donc :
OH- + H2O Û H2O + OH-
Cette réaction de basicité a une constante de basicité
Kb égale à 1 car le quotient réactionnel Q associé
à cette réaction vaut 1 puisque les composés formés
sont identiques aux réactifs consommés.
On a donc pour la base
OH- Q = Kb = 1
soit puisque Ka.Kb = Ke = 10-14
Soit Ka = 10-14 ou encore pKa = 14
4 - Bases fortes et faibles.
Pour les concentrations en acide habituellement rencontrées c’est à dire pour des concentrations nettement inférieures à 1 mol.L-1, on peut montrer alors que la réaction est quasi totale.
Une base B appartenant à un couple acide-base de pKa supérieur à 14 sera donc totalement transformée en ions OH- : on dit qu’il s’agit alors d’une base forte.
Une base B appartenant à un couple acide-base de pKa positif ne sera que partiellement transformé en ions OH- : on dit qu’il s’agit alors d’une base faible.
Conséquences (pour les concentrations habituelles : << 1 mol.L-1) :
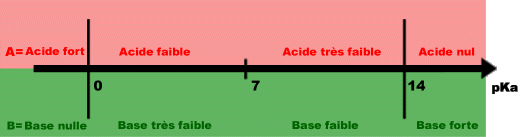
5 - Schéma récapitulatif :
Pour un couple acide base conjugué A / B, suivant la valeur du pKa, les forces respectives de A et de B seront comme indiqué sur ce schéma :